В поиске эффективных средств терапии болезни Альцгеймера — сложного мультифакторного нейродегенеративного заболевания — научный взгляд всё чаще обращается к мультитаргетным соединениям, способным одновременно воздействовать на несколько звеньев патологического процесса. Исследование посвящено созданию и изучению нового класса таких потенциальных терапевтических агентов.
Работа выполнена совместными усилиями международной командой специалистов:
- Института физиологически активных соединений Федерального исследовательского центра проблем химической физики и медицинской химии РАН (Черноголовка).
- Кафедры органической и биомолекулярной химии Уральского федерального университета (Екатеринбург).
- Института органического синтеза Уральского отделения РАН (Екатеринбург).
- Института цитологии РАН (Санкт-Петербург).
- Института биохимической физики им. Н. М. Эмануэля РАН (Москва).
- Department of Neurology, University of Michigan, Ann Arbor, USA
Результаты этой коллаборации были опубликованы в журнале «Pharmaceuticals», IF=4.8.
Ферроцен: уникальная основа для молекулярного конструирования
В центре исследования оказались производные ферроцена — молекулы, напоминающей “сэндвич”, где атом железа зажат между двумя органическими кольцами. Сама по себе эта структура биологически инертна, но её включение в состав более сложных молекул может кардинально менять их свойства: улучшать липофильность, стабильность и, что наиболее важно, повышать способность к окислительно-восстановительным реакциям. Это делает ферроцен ценным “строительным блоком” в медицинской химии, что ранее было подтверждено на примере противоопухолевого препарата ферроцифена (ferrocifen) и противомалярийного ферроквина (ferroquine)
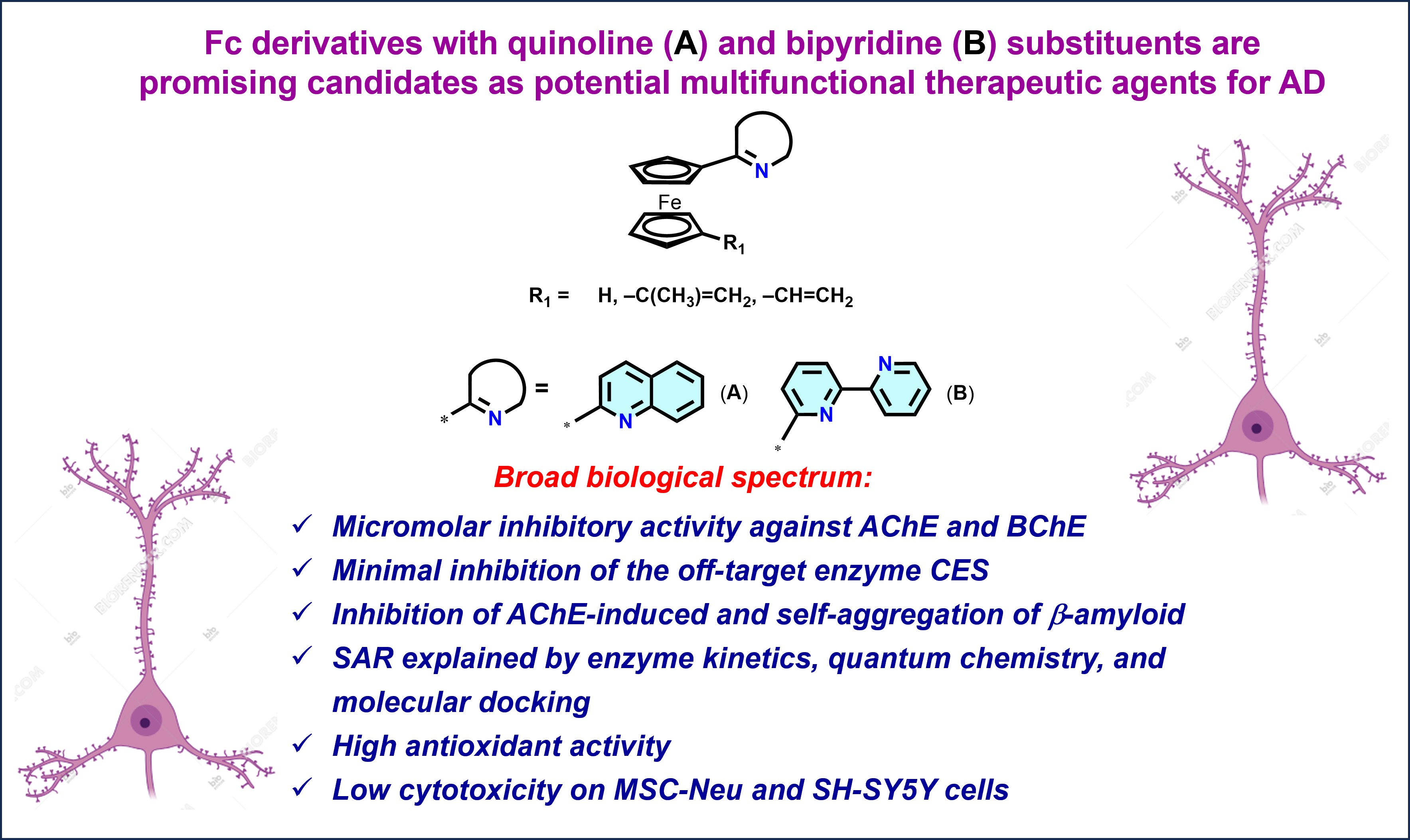
Были разработаны и оптимизированы методы синтеза, позволившие впервые получить 3 группы 1-алкенил-1ʹ-азинилферроценов с высоким выходом.
Синтезированные соединения прошли комплексное исследование в серии биологических тестов, моделирующих ключевые звенья патогенеза болезни Альцгеймера.
Ингибирование холинэстераз. Было показано, что производные хинолина и бипиридина эффективно подавляют активность ацетил- и бутирилхолинэстеразы (АХЭ и БХЭ) — ферментов, гидролизующих важный нейромедиатор ацетилхолин, уровень которого и так снижен при болезни Альцгеймера.
Борьба с окислительным стрессом. Все новые соединения, особенно хинолиновые производные, показали выдающуюся антиоксидантную активность в стандартных тестах (ABTS и FRAP), в 2-4 раза превосходящую активность стандартного антиоксиданта тролокса. Квантово-химические расчёты подтвердили, что именно сочетание ферроцена с азотистым гетероциклом изменяет механизм антиоксидантного действия ферроцена, делая его более эффективным.
Подавление агрегации β-амилоида. Агрегация пептидов β-амилоида и образование амилоидных бляшек — один из основных патологических процессов при болезни Альцгеймера. Многие из синтезированных соединений, в частности хинолиновые и акридиновые производные, эффективно блокировали самоагрегацию β-амилоида (до 90% ингибирования), и снижали АХЭ-индуцируемую агрегацию β-амилоида, вытесняя специфический маркер – пропидий из периферического анионного сайта фермента.
Низкая токсичность. Испытания на культурах нейрональных клеток (MSC-Neu) и клетках нейробластомы человека (SH-SY5Y) показали, что наиболее активные соединения обладают относительно низкой цитотоксичностью, особенно в отношении здоровых нейрональных клеток, что является важным преимуществом для потенциальных терапевтических агентов.
Наблюдаемые в эксперименте соотношения структура-биологическая активность были объяснены с использованием квантово-химических расчетов и молекулярного докинга с использованием современных методов генерации структуры белков-мишеней, таких как Protenix – воспроизведение алгоритма AlphaFold3.
Квантово-химические расчеты показали, что производные акридина в условиях эксперимента наиболее склонны к образованию стабильных димеров. Методами молекулярного докинга было подтверждено, что эти димеры являются слишком объемными для доступа к активным центрам ферментов, что объясняет их слабое ингибирование холинэстераз. Однако они могут связываться с белковыми поверхностями, и таким образом ингибировать АХЭ-индуцируемую (вытеснять пропидий из ПАС AХЭ) и самоагрегацию b-амилоида.
Напротив, хинолиновые и бипиридиновые производные преимущественно остаются в мономерной форме, что позволяет им как эффективно связываться в активных центрах холинэстераз, так и препятствовать АХЭ-индуцируемой и самоагрегации b-амилоида.
В заключение, следует отметить, что проделанная работа демонстрирует успешную стратегию создания полифункциональных соединений на основе ферроцена. Хинолиновые и бипиридиновые производные проявили себя как наиболее сбалансированные кандидаты, сочетающие в себе ингибирование ключевых ферментов, мощную антиоксидантную защиту, способность препятствовать формированию амилоидных агрегатов и низкую токсичность.
Полученные результаты открывают путь для дальнейших, более углублённых исследований, направленных на изучение фармакокинетики, биодоступности и, что критически важно, способности этих молекул проникать через гемато-энцефалический барьер in vivo. Разработанные соединения представляют собой перспективную основу для дизайна лекарственных средств, воздействующих на болезнь Альцгеймера с нескольких сторон одновременно.
Galina F. Makhaeva, Irina A. Utepova, Elena V. Rudakova, Nadezhda V. Kovaleva, Natalia P. Boltneva, Elena Yu. Zyryanova, Alexandra A. Musikhina, Vladimir F. Lazarev, Snezhana A. Vladimirova, Irina V. Guzhova, Ilya N. Ganebnykh, Tatiana Y. Astakhova, Elena N. Timokhina, Oleg N. Chupakhin, Valery N. Charushin andRudy J. Richardson //1-Azinyl-1′-Alkenylferrocenes with Anticholinesterase, Antioxidant, and Antiaggregating Activities as Multifunctional Agents for Potential Treatment of Alzheimer’s Disease // Pharmaceuticals, IF=4.8

