Дайджест №9 (февраль 2024)
Подготовлено Отделом информации ИФАВ РАН
1. VV116 по сравнению с нирмарелвиром-ритонавиром для перорального лечения Covid-19
VV116 versus Nirmatrelvir–Ritonavir for Oral Treatment of Covid-19
Z. Cao et al.
The New England Journal of Medicine 2023, 388 (5), 406-417
Объявленное Всемирной организацией здравоохранения (ВОЗ) пандемией в марте 2020 г. коронавирусное заболевание COVID-19 стало серьезной проблемой для медицинских работников, менеджеров и системы здравоохранения из-за быстрого распространения, отсутствия лечения, масштабности и непредсказуемости. Данные ВОЗ показывают, что около 15% случаев легкой/средней степени тяжести COVID-19 переходят в тяжелое заболевание, требующее госпитализации и респираторной поддержки, а у 5% пациентов развивается критическая форма, требующая госпитализации в отделение интенсивной терапии. Большое количество случаев COVID-19 вызвало массовый и внезапный приток пациентов в службы неотложной помощи, что привело к обширной госпитализации больных, нуждающихся в изоляции, кислородной поддержке, интубации и инвазивной искусственной вентиляции легких. Нирматрелвир (PF-07321332) – противовирусный препарат, разработанный компанией Pfizer, перорально активный ингибитор протеазы 3CLpro. В ноябре 2021 года Pfizer объявила о положительных результатах исследования фазы 2/3, в том числе о сокращении госпитализаций или смертельных исходов на 89% при назначении препарата «Паксловид» (Paxlovid, Bexovid), состоящий из комбинации нирматрелвира с ритонавиром, в течение трех дней после появления симптомов COVID-19 и на 85%, если лечение начинать в течение пяти дней.25 мая 2023 г. «Паксловид» был одобрен FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) для перорального лечения легкой и среднетяжелой степени тяжести COVID-19.VV116 представляет собой дейтерированный гидробромид ремдесивира с пероральной биодоступностью и высокой активностью против SARS-CoV-2 в исследованиях на животных. Он показал удовлетворительную безопасность и приемлемый профиль побочных эффектов в клиническом исследовании фазы 1. В клиническом многоцентровом, слепом, рандомизированном контролируемом исследовании участники с симптомами и с высоким риском развития тяжелой формы COVID-19 были случайным образом распределены в соотношении 1:1 для получения перорально VV116 (600 мг каждые 12 часов в 1-й день и 300 мг каждые 12 часов в дни со 2-го по 5-й) или комбинации нирмарелвир-ритонавир перорально (300 мг нирмарелвира плюс 100 мг ритонавира каждые 12 часов в течение 5 дней).В другом клиническом испытании принимали участие 822 пациента с легкой и умеренной формой COVID-19, у которых был высокий риск развития тяжелой формы заболевания. Из них 411 участников принимали комбинацию нирмарелвир-ритонавир и 411 участников- VV116. В течение 28 дней наблюдения участники, получавшие VV116, сообщили о меньшем количестве нежелательных явлений, чем те, кто получал комбинацию нирмателвир-ритонавир. В целом испытания показали, что VV116 не уступал комбинации нирмарелвир-ритонавир в сокращении времени достижения устойчивого клинического результата.
2. Ритлецитиниб: первое одобрение
Ritlecitinib: First Approval
Hannah A. Blair
Drugs 2023, 83(14), 1315-1321
Ритлецитиниб (PF-06651600) является высокоселективным и необратимым ингибитором янус-киназы 3 (JAK3).23 июня 2023 года он был одобрен FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) для лечения тяжелой очаговой алопеции (Alopecia areata) у взрослых и подростков от 12 лет и старше. Alopecia areata – это аутоиммунное заболевание, которое вызывает выпадение волос в основном в коже головы, а также на лице и других областях. В рандомизированном двойном слепом многоцентрового исследования фазы 2/3 пациенты в возрасте12 лет и старше с Alopecia areata и по меньшей мере 50% выпадением волос кожи были случайным образом распределены на прием перорального ритлецитиниба или плацебо один раз в день в течение 24 недель с последующим 24-недельным периодом расширения, в течение которого группа ритлецитиниба продолжала принимать назначенные дозы, а пациенты, первоначально получавшие плацебо, переключились на ритлецитиниб в дозах 50 мг или 200 мг. Испытания показали, что пероральный прием ритлецитиниба в дозах 30 мг или 50 мг один раз в день был эффективен и в целом безопасен и хорошо переносится в течение 48 недель у пациентов с Alopecia areata. Наиболее частыми нежелательными явлениями были головная боль, диарея, прыщи, сыпь, крапивница, фолликулит, пирексия, атопический дерматит, головокружение. По результатам испытаний сделаны выводы, что лечение ритлецитинибом в течение 48 недель привело к клинически значимому возобновлению роста волос у пациентов с Alopecia areata с выпадением волос на коже головы на уровне 50%. Витилиго – это хроническое аутоиммунное расстройство, характеризующееся депигментированными участками кожи. Варианты лечения витилиго ограничены, часто требуют длительного лечения и/или обладают ограниченной эффективностью. Ритлецитиниб был эффективен при лечении активного не сегментарного витилиго в клиническом, рандомизированном, двойном, слепом исследовании фазы 2 продолжительностью 48 недель, в котором участвовали пациенты в возрасте 18–65 лет с клиническим диагнозом не сегментарное витилиго в течение ? 3 месяцев. Долгосрочная оценка ритлецитиниба продолжается.
3. Болезнь Альцгеймера: новые мишени и исследуемые препараты для модификации заболевания
Alzheimer’s Disease:Novel Targets and Investigational Drugs for Disease Modification
Jeffrey L. Cummings et al.
Drugs 2023
Частота болезни Альцгеймера быстро растет во всем мире по мере старения населения. Увеличение глобальной популяции больных деменцией сопровождается тяжелыми социальными, экономическими, семейными и индивидуальными последствиями. Таким образом существует срочная необходимость разработки терапевтических вмешательств, которые могут предотвратить или отсрочить начало, замедлить прогрессирование или улучшить симптомы болезни Альцгеймера. Существует множество потенциальных целей для лечения болезни Альцгеймера и белки амилоид-b и тау являются каноническими фармакологическими мишенями для изменения заболевания. Терапевтические агенты, направленные на амилоид-b и тау, включают примерно 30% разработок лекарств от болезни Альцгеймера. Оставшиеся 70% представляют собой новые терапевтические стратегии для модифицирующего лечения болезни Альцгеймера. Мазитиниб представляет собой пероральный ингибитор тирозинкиназы, который воздействует на активированные клетки нейроиммунной системы (тучные клетки и микроглия). В клиническом исследовании мазитиниб оценивался в качестве дополнения к ингибитору холинэстеразы и/или мемантину у пациентов с легкой и умеренной деменцией, вызванной болезнью Альцгеймера.NE3107 является производным бета-андростентриола, естественного метаболита надпочечников. Исходное соединение было химически модифицировано для увеличения пероральной биодоступности и стабильности. В доклинических исследованиях NE3107 продемонстрировал противовоспалительную активность. В клинических испытаниях на пациентах с легкими когнитивными нарушениями или деменцией в дозах 20 мг два раза в день в течение 12 недель терапия препаратом NE3107 показала статистически значимые улучшения когнитивных функций. Семаглутид – синтетический аналог глюкагоноподобного пептида-1 (GLP-1) длительного действия, используемый для лечения диабета 2 типа и ожирения. Эпидемиологические исследования показывают, что диабетики, получающие лечение семаглутидом, менее склонны к развитию деменции, чем те, которые лечились другими противодиабетическими средствами. Другие аналоги GLP-1, такие,как эксендин-4 и лираглутид, в настоящее время проходят клинические испытания при лечении болезней Паркинсона и Альцгеймера. Барицитиниб является ингибитором Янус-киназы (JAK), одобренный для лечения ревматоидного артрита, тяжелой формы COVID-19, атопического дерматита и используется при очаговой алопеции. В декабре 2022 г. начались клинические испытания барицитиниба на пациентах с риском развития болезни Альцгеймера или бокового амиотрофического склероза. Симуфилам (PTI-125) – это новый исследовательский препарат для лечения болезни Альцгеймера. По состоянию на октябрь 2023 г. препарат находится на стадии 3 клинических испытаний. Существуют два клинических исследования 3 фазы: 52-недельное исследование, которое должно закончиться в 2024 году и второе, охватывающее 76 недель, которое планируется завершить в 2025 году. В обзоре приведены данные клинических испытаний и других препаратов для лечения болезни Альцгеймера (дазатиниб, кверцетин, бларкамезин и др.).
4. Пилотное исследование для оценки эффекта лечения CT1812 на синаптическую плотность и другие биомаркеры болезни Альцгеймера
A pilot study to evaluate the effect of CT1812 treatment on synaptic density and other biomarkers in Alzheimer’s disease
Christopher H.van Dyck et al.
Alzheimer’s Research & Therapy 2024, 16, 20
Болезнь Альцгеймера – возрастное прогрессирующее нейродегенеративное заболевание, характеризующееся нарушением когнитивных функций, потерей памяти и изменениями личности. Амилоид-b является ключевой мишенью для разработки лекарств на основе обширных фактических данных его участия в синаптической дисфункции и занимает центральное место в патофизиологии болезни Альцгеймера. Имеется ряд исследований, которые позволяют предположить, что олигомеры амилоида-b являются наиболее токсичной формой белка.CT1812, являющийся липофильным производным изоиндолина, также известный как Elayta, представляет собой низкомолекулярный антагонист рецептора сигма-2, который предотвращает и вытесняет связывание олигомеров амилоида-b с нейронами. Остановив ключевое инициирующее событие болезни Альцгеймера, этот препарат-кандидат смягчает нисходящую синаптотоксичность и восстанавливает когнитивные функции на моделях старых трансгенных мышей с болезнью Альцгеймера. После завершения первых клинических исследований на людях CT1812 прошел клинические испытания на пациентах с болезнью Альцгеймера. В клиническом исследовании 19 пациентов (10 мужчин и 9 женщин, средний возраст 70,2 года) с болезнью Альцгеймера легкой или средней степени тяжести были рандомизированы в группу приема с 3 вариантами доз CT1812 (90, 280 или 560 мг один раз в день) или группу плацебо перорально один раз в день в течение 28 дней для определения безопасности и переносимости препарата. По окончании испытания концентрация олигомера амилоида-b в спинномозговой жидкости у пациентов, получавших CT1812, значительно увеличилась по сравнению с группой пациентов, принимавшие плацебо. Этот вывод согласуется с доклиническими исследованиями, показывающими что CT1812 вытесняет и выводит токсичные олигомеры амилоида-b из мозга в спинномозговую жидкость и предоставляет подтверждающие доказательства клинической цели. CT1812 в целом был безопасен и хорошо переносился, нежелательные явления включали легкие головные боли или желудочно-кишечные расстройства. В качестве кандидата на терапию возрастных нейродегенеративных заболеваний CT1812 все еще находится в стадии разработки. В обзоре сделан вывод о перспективе использования CT1812 в качестве аллостерического антагониста рецепторов сигма-2 в качестве вероятного терапевтического кандидата для лечения легкой и умеренной болезни Альцгеймера.
5. Роль окислительного стресса в синаптической дисфункции и гибели нейрональных клеток при болезни Альцгеймера
Roles of Oxidative Stress in Synaptic Dysfunction and Neuronal Cell Death in Alzheimer’s Disease
German Plascencia-Villa et al.
Antioxidants 2023, 12(8), 1628
Болезнь Альцгеймера – хроническое прогрессирующее нейрогенеративное заболевание, поражающее кору головного мозга и гиппокамп, вызывая синаптические изменения, нейрональную недостаточность, ухудшение памяти и когнитивных функций, а также необратимую потерю нейронов. Отличительными признаками болезни Альцгеймера являются наличие аномальных белковых агрегатов амилоида-b и тау, синаптическая дисфункция, воспаление и гибель нейронов. Однако окислительный стресс или окислительное повреждение обычно игнорируется или считается следствием развития симптомов деменции. Окислительный стресс коррелирует с окислительным повреждением белков, нуклеиновых кислот и липидов в уязвимых популяциях клеток, что в конечном итоге приводит к гибели нейронов посредством различных молекулярных механизмов. Признавая окислительный стресс как неотъемлемый компонент болезни Альцгеймера, разрабатываются альтернативные терапевтические или профилактические мероприятия, которые тестируется в качестве потенциальных или дополнительных методов лечения этого разрушительного нейродегенеративного заболевания. Бларкамезин (ANAVEX2-73) является агонистом внутриклеточного рецептора сигма-1, он ингибирует митохондриальную дыхательную дисфункцию и предотвращает окислительный стресс, восстанавливая гомеостаз нервных клеток и повышая нейропластичность. В 57-недельном клиническом исследовании бларкамезина в дозах 20–30 мг/день на фазе 2а препарат показал безопасность, клиническую и фармакокинетическую переносимость и эффективность. Гидралазин использовался для лечения высокого кровяного давления и был одобрен FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США). Доклинические исследования показали, что гидралазин уменьшает неправильное сворачивание амилоида-b, окислительное повреждение липидов и нейротоксичность. Клиническое исследование фазы 3 оценивает эффективность гидралазина на пациентах с ранней стадией болезни Альцгеймера, принимающих один из ингибиторов ацетилхолинэстеразы (донепезил, ривастигмин или галантамин). Протокол включает прием дозы гидралазина в 25 мг каждые восемь часов в течение 1 года. Ресвератрол – вещество, принадлежащее к группе полифенолов, обладающее мощными антиоксидантными и противовоспалительными свойствами. Механизмы действия ресвератрола связаны с ингибированием агрегации амилоида-b и ингибированием свободных радикалов. Клинические испытания ресвератрола показали, что этот полифенол хорошо переносится молодыми и пожилыми людьми при введении 200 мг с интервалом в 8 часов, но он быстро метаболизируется и выводится из организма. В клиническом исследовании фазы 3 тестировалась пищевая добавка ресвератрола (5 мг) с глюкозой (5 г), назначаемая два раза в день в течение 1 года пациентам с легкой и умеренной степенью болезни Альцгеймера. Применение добавки продемонстрировало торможение ухудшения когнитивных функций, но ни один из когнитивных показателей не достиг статистической значимости. В обзоре приведены данные клинических испытаний и других препаратов для борьбы с окислительным стрессом (кофеин, куркумин, эпигаллокатехин галлат и др.).
6. О химических и биологических характеристиках многофункциональных соединений для лечения болезни Паркинсона
On the Chemical and Biological Characteristics of Multifunctional Compounds for the Treatment of Parkinson’s Disease
Olimpo Garcia-Beltran et al.
Antioxidants 2023, 12(2), 214
Болезнь Паркинсона – медленно прогрессирующее нейродегенеративное заболевание, которым страдают часть населения, как правило, старше 65 лет. Непосредственной причиной болезни Паркинсона является потеря дофаминергических нейронов в Substantia Nigra. Среди неврологических расстройств болезнь Паркинсона характеризуется быстрорастущей распространенностью в мире, часто приводя к инвалидности. Традиционно фармакологическое лечение болезни Паркинсона направлено на компенсацию снижения содержание дофамина, образующегося в результате гибели дофаминергических нейронов черной субстанции, либо с помощью добавок L-ДОФА, ингибирования моноаминооксидазы (МАО), либо агонистами дофаминовых рецепторов. Эти методы лечения улучшают качество жизни пациентов, но не останавливают гибель нейронов и в долгосрочной перспективе теряют эффективность. Патофизиологические события, связанные с гибелью дофаминергических нейронов, включают митохондриальную дисфункцию, которая приводит к окислительному стрессу. Ряд клинических исследований были направлены на уменьшение окислительного повреждения, наблюдаемого при болезни Паркинсона, путем использования коэнзима Q10 (CoQ10), который обладает мощными антиоксидантными свойствами. Одно из клинических исследований коэнзима Q10 показало снижение инвалидности у пациентов с ранней стадией болезни Паркинсона, получавших высокие дозы препарата (до 1200 мг в день), тогда как при низких и средних дозах (300 и 600 мг ежедневно соответственно) изменений не наблюдалось. Ресвератрол – вещество, принадлежащее к группе полифенолов, обладающее мощными антиоксидантными и противовоспалительными свойствами. Недавние работы подтвердили нейропротекторную активность ресвератрола против нейродегенеративных заболеваний. Пациенты с легкой и умеренной болезнью Альцгеймера получали лечение ресвератролом в течение 52 недель в дозе 1 г два раза в день перорально. По результатам испытаний сделан вывод, что ресвератрол модулирует нейровоспаление и может быть пригоден для лечения или профилактики психических расстройств. Одной из групп натуральных продуктов, обладающих нейропротекторными свойствами, являются флавоноиды. Гинкгетин – бифлавоноид, выделенный из гинкго (Ginkgo biloba L.), стандартизированный экстракт которого (EGb 761) используется в качестве поддерживающей терапии и для предотвращения когнитивных нарушений. Экстракт гинкго может замедлить прогрессирование потери памяти при болезни Альцгеймера, обычно при высоких дозах 240 мг и более в день и может оказывать поддерживающее и/или защитное действие при лечении болезни Паркинсона. Нарушенный гомеостаз железа связан с нейродегенерацией при болезнях Альцгеймера, Паркинсона и других заболеваниях. У пациентов с болезнями Альцгеймера и Паркинсона обнаружено повышенное содержание железа в определенных участках мозга. Деферипрон – это перорально доступный хелатор железа, который удаляет избыток железа из мозга и других тканей. В двух плацебо-контролируемых исследованиях шестимесячный курс 30 мг/кг ежедневного приема деферипрона замедлило снижение когнитивных функций у пациентов с болезнью Паркинсона. В обзоре сделан вывод, что многоцелевой подход, использующий многофункциональные агенты, который касается нескольких аспектов нейродегенеративной патологии, может быть лучшим подходом для остановки прогрессирования заболевания.
7. Основные моменты клинических испытаний: модуляторы митохондриальной функции
Clinical Trial Highlights: Modulators of Mitochondrial Function
Francesco Capriglia et al.
Journal of Parkinson’s Disease 2023, 13(6), 851–864
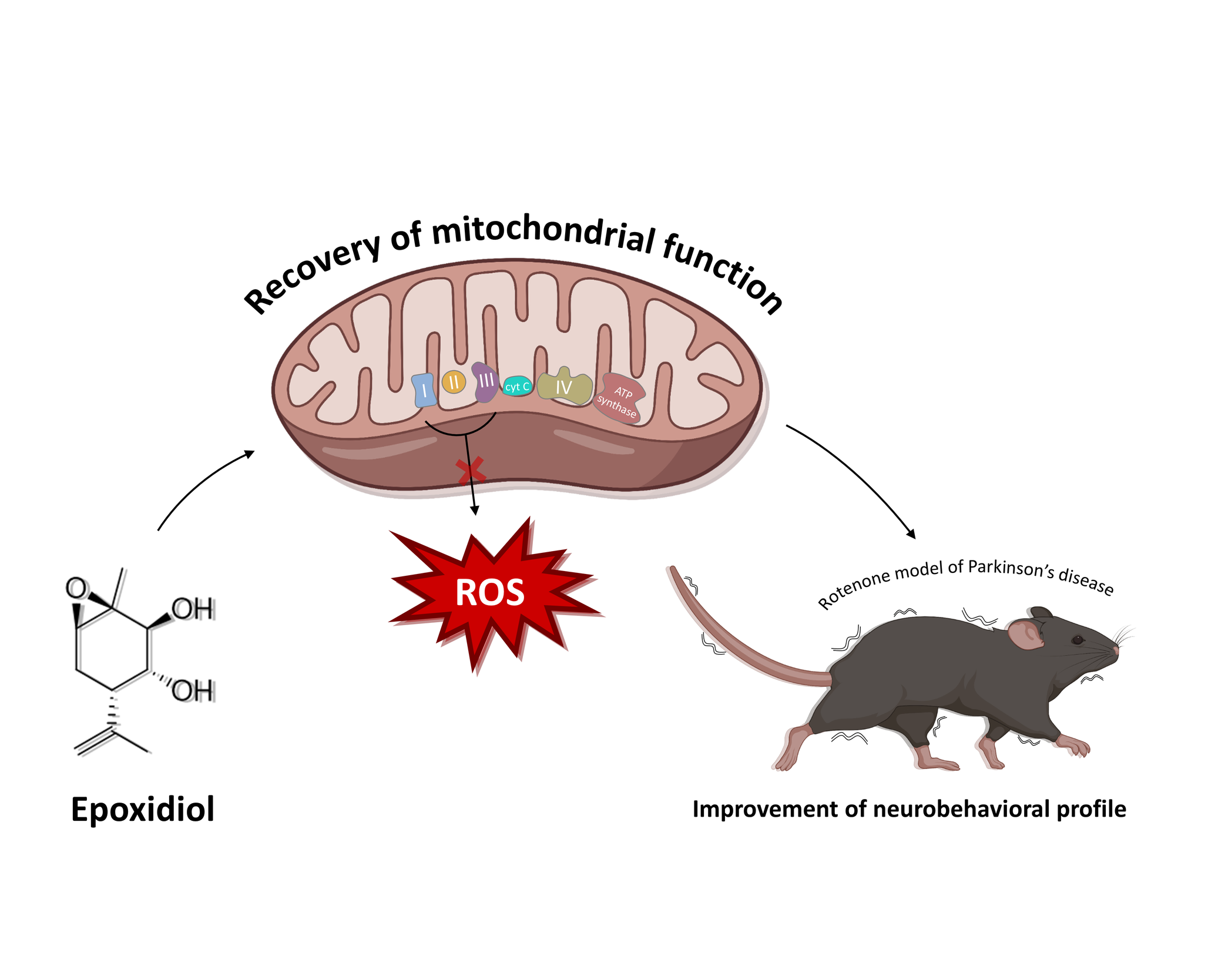
Болезнь Паркинсона – прогрессирующее нейродегенеративное заболевание, включающее нарушение походки, брадикинезию, ригидность и тремор. Это второе по распространенности нейродегенеративное расстройство. Митохондрии участвуют во многих динамических процессах, включая их роль в производстве энергетической основы клетки-аденозинтрифосфата. Митохондриальная дисфункция является ключевым патогенетическим механизмом при болезни Паркинсона и поэтому ее защита является многообещающей нейропротекторной стратегией при лечении болезни Паркинсона. Поскольку митохондрии имеют решающее значение для клеток, понятно, что любое терапевтическое воздействие, который усиливает функцию митохондрий, будет полезно для пациентов с болезнью Паркинсона. Следует признать, что митохондриальная дисфункция вряд ли является основной причиной заболевания у всех пациентов. Однако предполагается, что восстановление функции митохондрий у пациентов замедлит прогрессирование болезни, даже если митохондриальная дисфункция не является прямой причиной, а вторичным механизмом заболевания. Урсодезоксихолевая кислота показала себя в ряде доклинических исследований in vitro и на модели болезни Паркинсона in vivo перспективным агентом для защиты митохондрий. Урсодезоксихолевая кислота, также известная как урсодиол, представляет собой вторичную желчную кислоту, вырабатываемую у человека и большинства других видов животных в результате метаболизма кишечных бактерий. Было проведено рандомизированное двойное слепое исследование плацебо-контролируемое 48-недельное исследование урсодезоксихолевой кислоты при ежедневном приеме в дозе 30 мг/кг у пациентов с ранней стадией болезни Паркинсона с продолжительностью заболевания менее 3 лет после постановки диагноза. Результаты испытания подтвердили безопасность и переносимость урсодезоксихолевой кислоты. Из нежелательных явлений в группе лечения наблюдались легкая диарея и тошнота. Напротив, клиническая оценка применение урсодезоксихолевой кислоты не выявило возможной выгоды от ее воздействия на прогрессирование заболевания. Исрадипин – блокатор кальциевых каналов из группы дигидропиридина, одобренный FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) и использующийся для лечения гипертонии. Он оценивался в многоцентровом, двойном слепом плацебо-контролируемом исследовании в параллельных группах в качестве агента, модифицирующего заболевание у пациентов с ранней стадией болезни Паркинсона. В ходе него 170 пациентов получали 5 мг исрадипина два раза в день в течение 36 месяцев, при этом 166 пациентов получали плацебо. По результатам испытаний сделано заключении о безопасности препарата. Выявленными побочными эффектами были головокружение и периферические отеки, оба из которых возможно связаны с падением кровяного давления. В то же время исрадипин существенно не повлиял на прогрессирование заболевания у всех пациентов. В обзоре также приведены данные клинических испытаний и других модуляторов митохондриальной функции (никотинамид рибозид, идебенон, теразозин и др.).
8. Рекомендации по фармакотерапии болезни Альцгеймера-руководство по препаратам, одобренным FDA
Guidelines for pharmacotherapy in Alzheimer’s disease-A primer on FDA approved drugs
Ashvin Varadharajan et al.
Journal of Neurosciences in Rural Practice 2023, 14(4), 566–573
Деменция определяется как клинический синдром снижения когнитивных нарушений, достаточное для того, чтобы вызвать ухудшение профессиональной деятельности и повседневной жизни. Болезнь Альцгеймера – нейродегенеративное заболевание, которое является наиболее распространенной формой амнестической деменции у пожилых людей. Патофизиологию болезни Альцгеймера наиболее часто объясняют агрегацией бляшек амилоида-b и гиперфосфорилированием тау-белков. Эти нейродегенеративные процессы приводят к синаптической токсичности, нейровоспалению и снижению когнитивных функций. Лечение болезни Альцгеймера первоначально было сосредоточено на неспецифических усилении перфузии головного мозга и активности нейронов при помощи таких препаратов, как пирацетам, дигидроэрготоксин и пиритинол. Последующие препараты были направлены на исправление дисбаланса нейромедиаторов, вызванного нейродегенерацией в мозгу. Например, антихолинэстеразные препараты, такие как такрин, ривастигмин, галантамин и донепезил повышают уровень ацетилхолина в коре головного мозга, а антагонисты рецепторов NMDA, такие как мемантин, защищают нейроны от избыточной активности глутамата. Таким образом у врачей есть широкий арсенал фармакологически разнообразных препаратов для назначения пациентам с болезнью Альцгеймера. Целью этого обзора является всестороннее описание препаратов, одобренных FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) для смягчения симптомов и модификации прогрессирования болезни Альцгеймера и служить руководством для практикующих врачей. Брекспипразол является модулятором серотонин-дофаминовой активности, который также действует как частичный агонист серотониновых 5-HT1A и дофаминовых D2-рецепторов.Брекспипразол эффективен и хорошо переносится взрослыми при лечения шизофрении, а также используется в качестве дополнительного препарата к антидепрессантам при лечения тяжелых депрессивных расстройств.11 мая 2023 г. FDA объявило о разрешении на использование брекспипразола в качестве антипсихотика для лечения возбуждения, связанного с деменцией при болезни Альцгеймера. Эффективность брекспипразола для лечения возбуждения, связанного с деменцией, вызванной болезнью Альцгеймера, была определена в ходе двух 12-недельных рандомизированных двойных слепых плацебо-контролируемых исследований с фиксированными дозами. Возраст участников исследования был от 51 до 90 лет. Суворексант, антагонист рецепторов орексина, первоначально разработанный для лечения бессонницы, был одобрен FDA в 2020 г. для лечения нарушений сна при легкой и умеренной форме болезни Альцгеймера. Исследованиями установлено, что люди, страдающие болезнью Альцгеймера, имеют высокий уровень нейромедиатора орексина в спинномозговой жидкости, что способствует бодрствованию и приводит к развитию бессонницы. Суворексант блокирует действие рецепторов орексина, тем самым помогая в инициации и поддержании сна. Наиболее распространенными побочными эффектами препарата являются сонливость, диарея, ксеростомия, инфекции верхних дыхательных путей, головная боль, головокружение, утомляемость, диспепсия и периферические отеки. В обзоре приведены данные клинических испытаний и других одобренных FDA препаратов для лечения болезни Альцгеймера (донепезил, галантамин, ривастигмин и мемантин).
9. Новый терапевтический потенциал каннабидиола (CBD) при неврологических расстройствах: комплексный обзор
Emerging Therapeutic Potential of Cannabidiol (CBD) in Neurological Disorders:A Comprehensive Review
Kuldeep Singh et al.
Behavioural Neurology 2023, 2023, 8825358
Неврологические расстройства оказывают значительное влияние на качество жизни и функционирование человека. Самые распространенные из них включают эпилепсию, рассеянный склероз, болезнь Паркинсона, болезнь Альцгеймера, нейропатические боли и тревожные расстройства. Влияние неврологических расстройств может быть существенным, воздействуя на человека физически, умственно и эмоционально. Эти состояния часто приводят к хронической боли, инвалидности и снижению способности выполнять повседневную деятельность. Кроме того, неврологические расстройства могут оказывать существенное влияние на психическое здоровье, что приводит к депрессии, тревоге и социальной изоляции. В последние годы растет интерес к потенциальным терапевтическим эффектам каннабидиола в лечении неврологических расстройств. Каннабидиол, полученный из Cannabis sativa, привлекает значительное внимание благодаря отсутствию у него психоактивных свойств и возможному терапевтическому применению. В обзоре проведен тщательный анализ растущему значению каннабидиола в лечении неврологических заболеваний, включая эпилепсию, множественный склероз, болезнь Паркинсона и болезнь Альцгеймера, которые представляют собой серьезную проблему для здравоохранения во всем мире. В 2018 г. FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) одобрило эпидиолекс, препарат на основе каннабидиола, для лечения некоторых видов эпилепсии. В рандомизированном клиническом контролируемыми исследовании пациентам перорально вводили каннабидиол в дозах 10 или 20 мг/кг/день наряду с одним или несколькими противоэпилептическими препаратами (клобазам, вальпроат, ламотриджин и/или леветирацетам) в течение 14 недель. В результате в группе, получавшей каннабидиол, частота судорог значительно снизилась (примерно на 37-42%) по сравнению с группой, принимавшей плацебо. Общее состояние здоровья улучшилось более чем у 50% пациентов. По данным другого открытого клинического исследования у пациентов с болезнью Паркинсона, получавших каннабидиол в дозах 20–25 мг/кг/день в течение 10–15 дней наблюдался прогресс в повседневных задачах, таких как личная гигиена, одевание, мелкая моторика (например, письмо) и обращение с предметами без пролития по сравнению с группой плацебо. Несмотря на определенные оптимистические результаты, важно отметить, что исследования по каннабидиолу все еще находятся на ранних стадиях и необходимы более строгие клинические испытания для установления его безопасности и эффективности.
10. Варианты лечения болезни Альцгеймера: обзор амилоида, тау и альтернативных гипотез
Treatment options for Alzheimer’s Disease:An overview of the amyloid,tau,and alternate hypotheses
Eroltu K.
Journal of High School Science 2023, 7(4)
Болезнь Альцгеймера-прогрессирующее заболевание головного мозга, которое влияет на память, мышление и поведение. Она чаще встречается у людей в возрасте 65 лет и старше. Начало болезни Альцгеймера отмечается постепенными, но постоянными проблемами с речью, потерей памяти и спутанностью сознания, которые затрудняют повседневную деятельность, часто оставляя пациентов все более зависимыми от постоянной помощи в их личной жизни. Предполагается, что накопление амилоида-b в головном мозге является ключевым фактором прогрессирования болезни Альцгеймера, хотя точные причины еще предстоит выяснить. Гипотезы амилоида-b и тау при болезни Альцгеймера предполагают, что накопление амилоидного белка в мозге и образование тау-клубков являются ключевыми драйверами заболевания. Поэтому многие исследователи сосредоточились на разработке лекарств, которые могут быть нацелены на эти отклонения, чтобы замедлить или остановить прогрессирование заболевания. Тем не менее, эти препараты не смогли достичь конечных клинических результатов. В обзоре сделан подробный анализ как традиционных, так и альтернативных подходов к терапии болезни Альцгеймера. Рилузол – первый одобренный FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) препарат для лечения бокового амиотрофического склероза. Механизм действия рилузола до конца не изучен, но неоднократно было показано, что он модулирует нейротрансмиссию глутамата путем ингибирования как высвобождения глутамата, так и передачи сигналов постсинатическими глутаматными рецепторами. Рилузол завершил третью фазу клинических испытаний по лечению болезней Паркинсона и Хантингтона. Обе программы дали отрицательные результаты и были прекращены. Энцениклин (EVP-6124) является частичным селективным агонистом ?-7 никотинового рецептора ацетилхолина (?7-NACHR). Он разрабатывался для лечения когнитивного дефицита при шизофрении и болезни Альцгеймера. В клиническом исследовании с участием 49 пациентов с легкой до умеренной степени болезни Альцгеймера в течение 28 дней о серьезных побочных явлениях не сообщалось. Из результатов испытаний сделаны выводы, что энцениклин в дополнение к терапии ингибиторами ацетилхолинэстеразы донепезилом или ривастигмином, по-видимому, улучшал внимание, беглость устной речи и исполнительные функции. Таренфлурбил представляет собой R-энантиомер нестероидного противовоспалительного средства флурбипрофена, структурно и фармакологически родственного ибупрофену и используемого для лечения ряда воспалительных состояний. В 12-месячном клиническом исследовании фазы 2 с участием 210 человек с болезнью Альцгеймера легкой и средней степени тяжести сравнивали влияние 400–800 мг таренфлурбила два раза в день с плацебо на когнитивные функции. К плацебо-контролируемой фазе испытания было добавлено продление на 12 месяцев. Это исследование не выявило влияния на когнитивные функции, но сообщило о небольшом улучшении функций лечения только при более высоких дозах и только при легкой степени болезни Альцгеймера. Побочные эффекты включали тошноту, головокружение и диарею, но в целом таренфлурбил переносился хорошо. Ряд исследований показывают, что таренфлурбил может успешно снижать накопление бляшек амилоида-b внутри мозга. В обзоре приведены данные клинических испытаний и других препаратов (брекспипразол, дантролен, веруцестат и др.).Дизайн и поддержка сайта: От